Klasycznym przykładem problemów stawianych młodym chemikom jest przeliczanie stężeń i mieszanie roztworów. W tym artykule chciałbym się skupić na tzw. regule św. Andrzeja, która znacznie ułatwia rozwiązywanie tego typu zadań.
Reguła św. Andrzeja bywa nazywana różnie, w literaturze można spotkać następujące określenia: kwadrat rozcieńczeń, reguła mieszania, reguła krzyża, jednak wszystkie odnoszą się do tego samego.
Załóżmy że mamy dwa roztwory o znanym stężeniu procentowym Cp1 i Cp2, przy czym spełniona jest zależność:
Cp1 > Cp2
W takim wypadku, gdy zmieszamy oba roztwory w dowolnych proporcjach otrzymamy roztwór o stężeniu końcowym Cpx spełniającym warunek:
Cp1 > Cpx > Cp2
Oczywistym jest, że masa wynikowego roztworu mrx będzie się składać z masy poszczególnych roztworów składowych mr1 i mr2:
mrx = mr1 + mr2
Podobnie jest z masą substancji rozpuszczonej msx w roztworze końcowym:
msx = ms1 + ms2
Po przyjęciu odpowiednich założeń możemy przedstawić graficznie kwadrat rozcieńczeń:
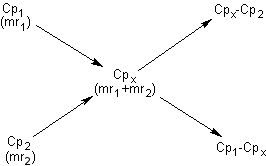
Z grafu wynika treść reguły św. Andrzeja w odniesieniu do stężenia procentowego:

Stosunek mas zmieszanych roztworów jest odwrotnie proporcjonalny do różnicy stężeń roztworu początkowego i końcowego.
Aby poznać sposób użycia kwadratu rozcieńczeń rozwiążmy kilka zadań.
Zadanie 1.
Oblicz w jakich proporcjach masowych należy zmieszać roztwór stężeniu procentowym równym 6% z roztworem o stężeniu procentowym równym 10%, aby otrzymać roztwór o stężeniu 8%.
Z treści zadania mamy:
Cp1 = 10% Cp2 = 6% Cpx = 8%
Układamy schemat:

Układamy proporcję:

Jak widać podane roztwory należy zmieszać w stosunku 1:1.
Zadanie 2.
Zmieszano 30g roztworu o st. proc. 5% i 75g roztworu o st. proc. 20%. Oblicz stężenie procentowe wynikowego roztworu.
Dane:
Cp1= 20% Cp2 = 5%
mr1 = 75g mr2 = 30g
Cpx = ?
Wkładamy schemat:

Następnie proporcję:
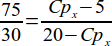
75(20-Cpx) = 30(Cpx-5)
1500 - 75Cpx = 30Cpx - 150
-105Cpx = -1650
Cpx = 15,71%
Zadanie 3.
W jakich proporcjach masowych należy zmieszać ocet 10% z wodą, aby otrzymać ocet 6%?
Za stężenie kwasu octowego w czystej wodzie przyjmujemy 0%.
Układamy schemat:

Jak widać z grafu, aby otrzymać ocet 6% należy zmieszać ocet 10% z wodą w stosunku masowym 3 do 2.
W jakim stosunku masowym należy zmieszać 80-procentowy kwas siarkowy z 20-procentowym kwasem siarkowym, aby otrzymać roztwór 30-procentowy?
Układamy graf:

Następnie proporcję:

Aby otrzymać roztwór 30% należy zmieszać roztwór 80% z roztworem 20% w stosunku masowym 1 do 5.


