Obliczanie pH roztworów kwasów.
Obliczanie pH kwasów należy rozpocząć od ocenienia wzgędnej mocy danego kwasu:
- kwasy mocne: kwas solny(HCl), kwas azotowy(V)(HNO3), kwas siarkowy(VI)(H2SO4), kwas bromowodorowy(HBr), kwas jodowodorowy(HI), kwas chlorowy(V)(HClO3), kwas chlorowy(VII)(HClO4), kwas managanwy(VII)(HMnO4)
- kwasy słabe: kwas węglowy(H2CO3), kwas siarkowy(IV)(H2SO3), kwas azotowy(III)(HNO2), kwas cyjanowodorowy(HCN) i inne.
1. Obliczanie pH kwasów mocnych.
Do obliczenia pH potrzebne jest stężenie molowe kationów wodorowych(H+). Aby obliczyć stężenie H+ należy pomnożyć stężenie molowe kwasu przez liczbę protonów w cząsteczce danego kwasu, np.:
- 0,02 molowy roztwór HCl: cH+= 0,02mol/dm3 · 1 = 0,02mol/dm3
- 0,003 molowy roztwór H2SO4: cH+= 0,003mol/dm3 · 2 = 0,006mol/dm3
Mając cH+ możemy je wstawić do wzoru i obliczyć pH:
pH = -log[H+] np.: pH = -log(0,02) pH=1,7
2. Obliczanie pH kwasów słabych.
W przypadku kwasów słabych sprawa jest trudniejsza, gdyż nie wszytkie cząsteczki kwasu znajdujące się w roztworze ulegają dysocjacji. W takim wypadku, aby obliczyć stężenie kationów wodorowych należy ułożyć równanie stałej dysocjacji danego kwasu i wyprowadzić zależność opisującą interesujące nas stężenie.
Zagadnienie to wyjaśnimy na przykładzie:
Oblicz pH roztworu kwasu azotowego(III) o stężeniu 0,01 mol/dm3, jeśli stała dysocjacji HNO2 wynosi 5,62 · 10-4.
W pierwszym kroku układamy równanie reakcji dysocjacji:
HNO2 ↔ H+ + NO2-
Następnie układamy równanie na stałą dysocjacji i przyjmujemy odpowiednie uproszczenia:
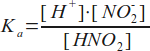 [H+] = [NO2-] = x
[H+] = [NO2-] = x
[HNO2] = cHNO2 - x
Podstawiamy uproszczenia do wzoru i dokonujemy przekształceń:

Otrzymujemy równanie kwadratowe, do którego podstawiamy wartości liczbowe podane w treści zadania i następnie rozwiązujemy:
x2 + 5,62·10-4x - 5,62 · 10-4 · 0,01 = 0
x1<0 x2=0.00211
Otrzymany wynik jest stężeniem kationów wodorowych, który wystarczy podstawić do wzoru:
pH = -log[0,00211] pH=2,68


